新闻记者 陆缘
通讯员 王琼 田瑶林 曹兴富
近日,武汉光谷生物城企业凯德维斯生物技术有限公司全资子公司武汉凯德基诺生物技术有限公司(以下简称“凯德基诺”)宣布,其自主研发的KDTV001注射液于10月24日获得美国食品药品监督管理局(FDA)新药临床试验申请(IND)许可,用于治疗HPV-16型和/或18型和/或52型感染相关的鳞状上皮内瘤变和相关癌症,成为全球首个批准开展该适应症临床试验的腺病毒载体治疗性疫苗。这是继2025年10月11日获中国国家药品监督管理局(NMPA)IND批准后,该项目全球化布局的又一重要进展。
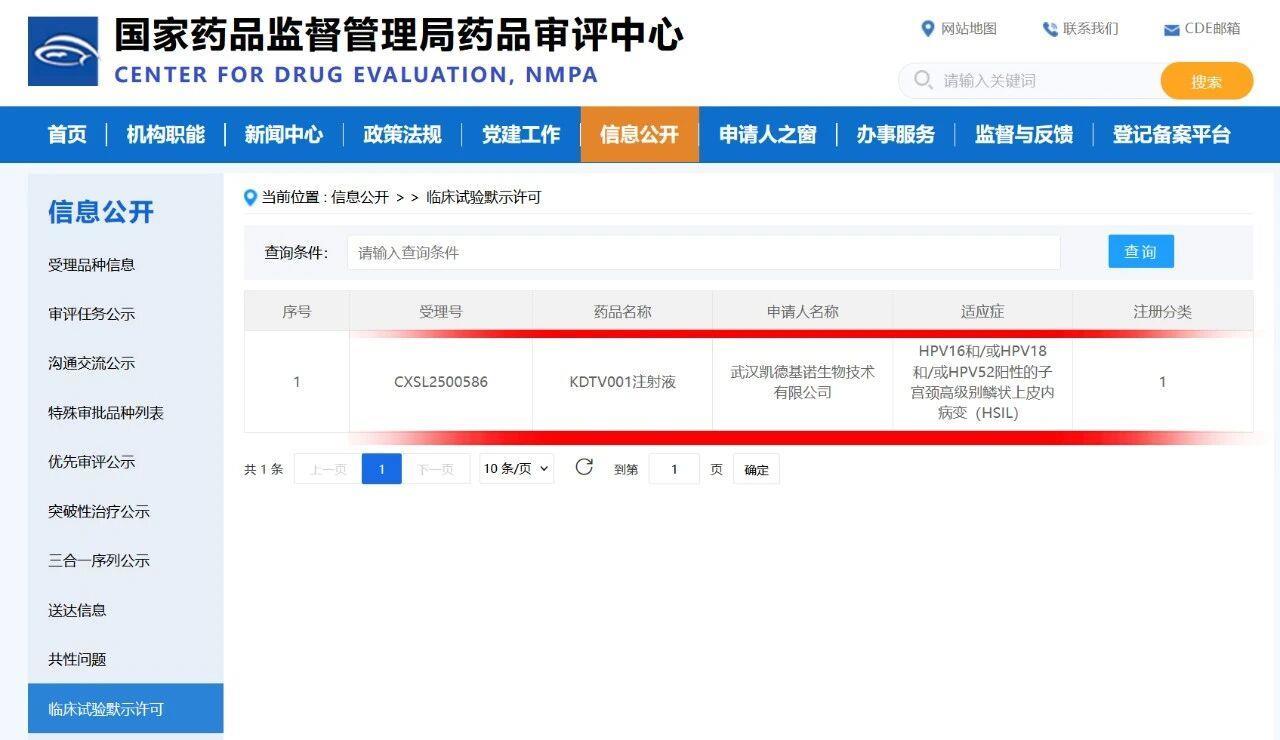
基于该项批准,凯德基诺将于美国启动一项I期临床试验。该研究为多中心、开放标签、随机、剂量递增及扩展设计,旨在评估KDTV001注射液在16型和/或18型和/或52型人乳头瘤病毒(HPV)相关宫颈高级别鳞状上皮内病变患者中的安全性、耐受性、免疫原性及初步疗效。子宫颈癌是常见的妇科恶性肿瘤之一,发病率在我国女性恶性肿瘤中居第二位。
自2009年起,国家将宫颈癌和乳腺癌筛查纳入重大公共卫生服务项目。为进一步提升筛查覆盖率,2019年起“两癌”筛查被纳入基本公共卫生服务项目。2020年,国家卫生健康委员会妇幼健康司表示,中国将全力支持WHO提出的《加速消除宫颈癌全球战略》,并与193个国家携手,通过明确疫苗接种、筛查与治疗三级防治路径,共同推进全球消除宫颈癌目标的实现。
武汉凯德基诺生物积极响应世界卫生组织《加速消除宫颈癌全球战略》以及国家卫生健康委、国家药监局等十部委联合印发的《国家卫生健康委关于贯彻2021-2030年中国妇女儿童发展纲要的实施方案》,共同推动实施中国加速消除宫颈癌行动计划,并提出中国方案。
据介绍,针对HPV-16/18/52型感染相关的宫颈鳞状上皮内瘤变及相关癌症,凯德基诺开发的基于重组人5型腺病毒载体的HPV治疗性生物制品——KDTV001注射液,采用非复制型Ad5为载体和多价抗原设计,可同时递送HPV-16/18/52型E6-E7融合抗原,通过抗原提呈细胞(APC)对特异性抗原的识别与处理,诱导产生多层次的免疫应答,这种系统性免疫应答可实现全身性的HPV病毒清除,有效逆转高级别宫颈上皮内瘤变(CIN),促进宫颈组织修复。
责编:摄影网